Verbesserung der Luftqualität: Stickoxidfixierung durch Stadtbäume
von:Jiangli Zhang¹,8, Andrea Ghirardo², Antonella Gori³,4, Andreas Albert², Franz Buegger¹, Rocco Pace5,6, Elisabeth Georgii¹, Rüdiger Grote5, Jörg-Peter Schnitzler², Jörg Durner¹,7, Christian Lindermayr¹
Autoren: Jiangli Zhang1,8, Andrea Ghirardo2, Antonella Gori3,4, Andreas Albert2, Franz Buegger1, Rocco Pace5,6, Elisabeth Georgii1, Rüdiger Grote5, Jörg-Peter Schnitzler2, Jörg Durner1,7, Christian Lindermayr1
Pflanzen sind in der Lage Stickoxide aufzunehmen und mit Hilfe von Phytoglobinen als Stickstoffquelle zu nutzen. Die Stickoxid Aufnahme-/Depositionskapazität von Stadtbäumen stellt somit ein praktikables Mittel zur Reduzierung des atmosphärischen NOx-Gehalts dar und trägt zur Einhaltung von Luftreinhaltungsstandards bei. Die Auswahl geeigneter Baum-/Pflanzenarten, die in der Lage sind, mit erhöhtem Hitze- und Trockenstress umzugehen und gleichzeitig eine hohe Kapazität zur "Reinigung" der Luft beizubehalten, kann somit zukünftige Stadtplanungsstrategien unterstützen.
Die urbane Luft stellt in den meisten Teilen der Welt ein Gesundheitsrisiko dar, wobei Emissionen aus industriellen Prozessen, Hausheizungen und starkem Verkehr, der auf fossilen Brennstoffen basiert, die Hauptursachen sind. Dies führt zu hohen Werten von Partikeln, Stickoxiden (NOx) und anderen gesundheitsgefährdeten Verbindungen. Insbesondere NOx, die durch die Reaktion von Stickstoff- und Sauerstoffverbindungen bei Verbrennungsprozessen entstehen, sind sehr besorgniserregende Schadstoffe, da sie in direktem Zusammenhang mit Herz-Kreislauf-Erkrankungen, Atemwegserkrankungen und Allergien stehen (Mannucci et al., 2015; Zhao et al., 2016). In Gebieten mit starkem Fahrzeugverkehr, wie zum Beispiel in Großstädten und Ballungsräumen, ist die Menge an freigesetztem NOx oft erheblich und die daraus resultierenden Konzentrationen übersteigen oft die nationalen Vorschriften. Im Jahr 2017 wurde beispielsweise an etwa 10 Prozent aller Messstationen in Europa der Jahresgrenzwert von 40 µGramm pro Kubikmeter (NO2) überschritten (EEA, 2019). Pflanzen scheinen eine wichtige Rolle bei der Abschwächung NOx-bedingten Schäden für Gesundheit und Umwelt zu spielen, da ihre große Oberfläche effiziente "Senken" für Luftschadstoffe darstellt (Hill, 1971). In Städten hat die luftreinigende Funktion von Pflanzen/Bäumen in Kombination mit anderen Ökosystemleistungen (Absenkung der Lufttemperatur) das Potenzial, die menschliche Gesundheit zu verbessern und gleichzeitig die Auswirkungen des Klimawandels abzuschwächen (Salmond et al., 2016; Kabisch und van den Bosch, 2017). Pflanzen entfernen gasförmige Luftschadstoffe durch Aufnahme über die Spaltöffnungen der Blätter und durch Ablagerung auf die Pflanzenoberfläche (Jud et al., 2016; Elkiey et al., 1982). Die Fähigkeit, NO2 zu absorbieren, wurde für eine Vielzahl von Pflanzenarten berichtet, einschließlich vieler Baumarten, wie Loblolly-Pine (Pinus taeda), Weißeiche (Quercus alba), Weißbirke (Betula pendula), Rotbuche (Fagus sylvatica), Stieleiche (Quercus robur), Steineiche (Quercus ilex), Kalifornische Eiche (Quercus agrifolia), Waldkiefer (Pinus sylvestris) und Rotfichte (Picea abies) (Rogers et al. , 1979; Geßler et al., 2002; Eller und Sparks, 2006; Chaparro-Suarez et al., 2011; Breuninger et al., 2013; Delaria et al., 2018). Die NO2-Deposition wird von den Spaltöffnungen, dem Stickstoffstatus, der Blattentwicklung und dem Blattalter, der Photosyntheserate und der Position der Blätter innerhalb des Pflanzendaches beeinflusst (Sparks et al., 2001; Hu und Sun, 2010; Morikawa et al., 1998, Takahashi et al., 2005). Somit ist ein deutlicher Unterschied zwischen den Baumarten und eine Abhängigkeit von der Vitalität zu erwarten. Im Gegensatz zur NO2-Deposition liegen zur NO-Aufnahme durch Pflanzen nur wenige Daten vor. Messungen der atmosphärischen NO-Konzentrationen in Gegenwart von Gartenbaukulturen, wie zum Beispiel Salat, Erdbeere, Apfel und Banane, zeigten eine signifikante Abnahme des atmosphärischen NO, was auf eine NO-Aufnahmen durch die Pflanzen hinweist (Hanson und Lindberg, 1991; Soegiarto et al., 2003).
SUG-Stellenmarkt

Wenn NOx durch die Spaltöffnungen aufgenommen wird, muss es weiterverarbeitet oder in der Pflanzenstruktur abgelagert werden. Tatsächlich gibt es Hinweise darauf, dass verschiedene Enzyme die Fähigkeit besitzen, NOx zu metabolisieren. So zum Beispiel Phytoglobine (PGBs), die Teil des Stickstoffmetabolismus sind und ubiquitär in Pflanzen vorkommen (Becana et al., 2020). PGBs können bei hypoxischem Stress NO zu Nitrat oxidieren, was als PGB/NO-Zyklus bezeichnet wird (Igamberdiev und Hill, 2004; Igamberdiev et al., 2006; Becana et al., 2020). In Arabidopsis und Gerste wurde bereits über die Fähigkeit der PGBs berichtet, atmosphärisches NO zu fixieren und als Stickstoffquelle zu nutzen (Kuruthukulangarakoola et al., 2017; Zhang et al., 2019). Dieser neue NO-Fixierungsprozess scheint möglicherweise eine wichtige Rolle innerhalb des gesamten Stickstoffzyklus zu spielen, der für den Aufbau von Proteinen, Nukleinsäuren, Chlorophyll und vielen anderen organischen Verbindungen essentiell ist. Obwohl die Fähigkeit zur NOx-Aufnahme in Pflanzen ubiquitär zu sein scheint, ist die tatsächliche Aufnahmekapazität der verschiedenen Pflanzenarten wahrscheinlich unterschiedlich (Takahashi et al., 2005)
In naher Zukunft wird sich die Zusammensetzung der Baumarten in städtischen Gebieten in Richtung klimaresistenter Arten verändern, die mit einer Zunahme der Intensität, Häufigkeit und Schwere abiotischer Belastungen umgehen können (Burley et al., 2019). Insbesondere Trocken- und Hitzetoleranz sind primäre Auswahlkriterien für städtische Begrünungsprogramme (z. B. Roloff et al., 2009). Im Rahmen einer lang angelegten Studie (Stadtgrün 2021) wurden stresstolerante Arten wie Carpinus betulus, Fraxinus ornus, Fraxinus pennsylvanica, Ostrya carpinifolia, Celtis australis, Alnus spaethii, Alnus glutinosa und Tilia henryana als Stadtbäume der Zukunft identifiziert (Böll, 2017, 2018a, 2018b; Dickhaut und Eschenbach, 2019). Allerdings ist durchaus denkbar, dass solche klimaresistenten Bäume zur Reduktion des Wasserverlustes eine reduzierte stomatäre Leitfähigkeit aufweisen und somit eine geringere NOx-Abbaukapazität besitzen. Daher sollten die ausgewählten hitze- und trockentoleranten Baumarten auch hinsichtlich ihrer NOx-Aufnahmekapazität überprüft werden.
NOx-Ablagerungsgeschwindigkeiten und ¹5NO-Markierungsstudien in verschiedenen Baumarten
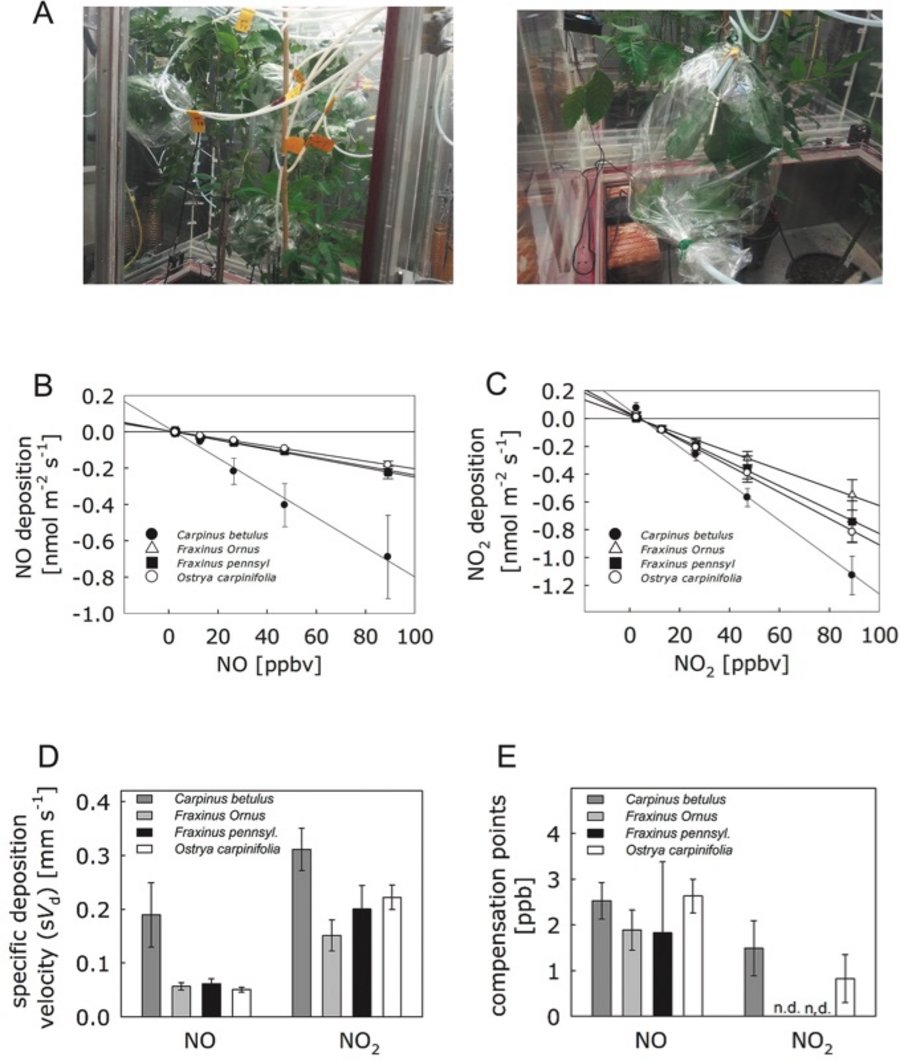
Um eine quantitative Abschätzung der Schadstoffentfernung aktueller und potenzieller zukünftiger Baumarten zu erhalten, wurde die NO- und NO2-spezifischen Depositionsgeschwindigkeiten an den Blattoberflächen von C. betulus, F. ornus, F. pennsylvanica und O. carpinifolia bestimmt. Das Experiment wurde unter kontrollierten Bedingungen in speziellen Klimakammern durchgeführt. Für jede der vier Pflanzenarten wurde jeweils ein Zweig mit fünf bis acht Blättern in einen Beutel eingeschlossen (Abbildung 1A).
Über die Zuluft wurden steigende Konzentrationen von NO und NO2 bis zu 90 parts per billion (ppb) appliziert und über die Abluft die konzentrationsabhängige Reduktion des NO und NO2 durch die verschiedenen Baumarten ermittelt (Abbildungen 1B, C). Anschließend wurden die Depositions- und Kompensationsparameter für NO und NO2 bestimmt (Abbildungen 1D, E).
Das Laub von C. betulus zeigte die höchste NO-Deponierungsgeschwindigkeit, auch wenn sie sich statistisch nicht von der der anderen Baumarten unterschied (Abbildung 1D). Ebenso war die NO2-Ablagerungsgeschwindigkeit in den Blättern von C. betulus im Vergleich zu den anderen Baumarten tendenziell höher (Abbildung 1D). Die ermittelten Ausgleichspunkte für NO lagen im Bereich von 1,8-2,6 ppb und für NO2 im Bereich von 0,8-1,5 ppb (Abbildung 1E).
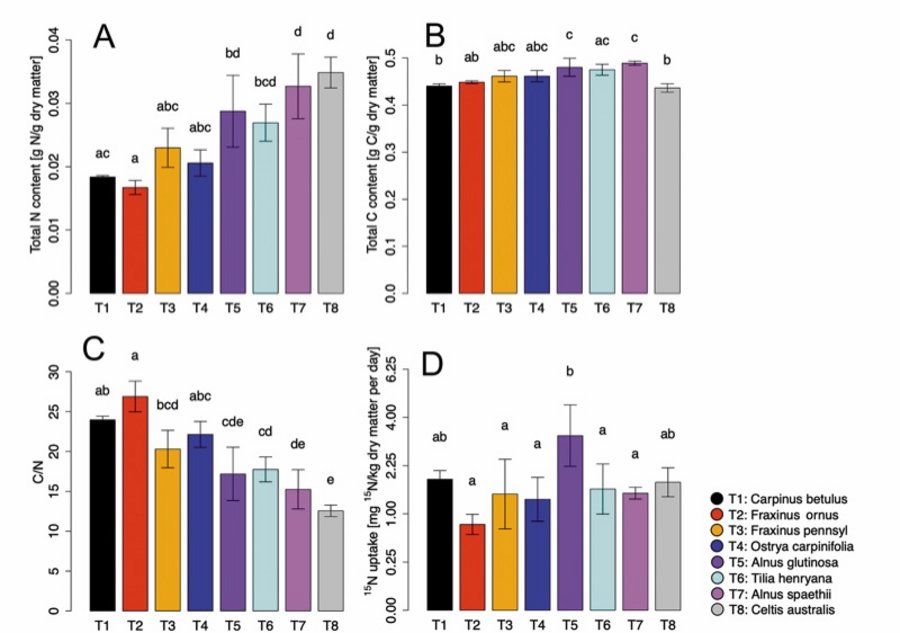
Um die NO-Aufnahmekapazität von Baumblättern zu untersuchen, wurde ein ¹5NO-Markierungsexperiment mit den oben genannten Arten durchgeführt. Darüber hinaus wurden vier weitere Baumarten (C. australis, A. spaethii, A. glutinosa und T. henryana) in die Analyse einbezogen. Die Bäume wurden fünf Tage lang 50 ppb ¹5NO ausgesetzt (50 ppb unmarkiertes NO als Kontrolle). Anschließend wurden der Gesamt-N- und -C-Gehalt, das C/N-Verhältnis und der ¹5N-Gehalt bestimmt. Die Bäume unterschieden sich in ihrem Gesamt-N-Gehalt in der Trockenmasse, der von 0,016 Gramm pro Gramm Trockenmasse (F. ornus) bis 0,036 Gramm pro Gramm Trockenmasse (C. australis) reichte (Abbildung 2A).
Der Gesamt-C-Gehalt lag im Bereich von 0,42 bis 0,51 Gramm pro Gramm Trockensubstanz, mit signifikant größeren Werten bei beiden Alnus-Arten als bei C. australis, F. ornus und C. betulus (Abbildung 2B). Folglich beobachteten wir ein C/N-Verhältnis zwischen 13 (C. australis) und 26 (F. ornus) (Abbildung 2C). Die höchste tägliche ¹5N-Aufnahme wurde in A. glutinosa (3,6 mg pro kg Trockenmasse) gefunden, gefolgt von C. betulus und C. australis. Die geringste tägliche ¹5N-Aufnahme wurde in F. ornus (0,8 mg pro kg Trockenmasse) festgestellt (Abbildung 2D).
Modellierung der NO2- und NO-Trockendeposition für Berlin-Mitte
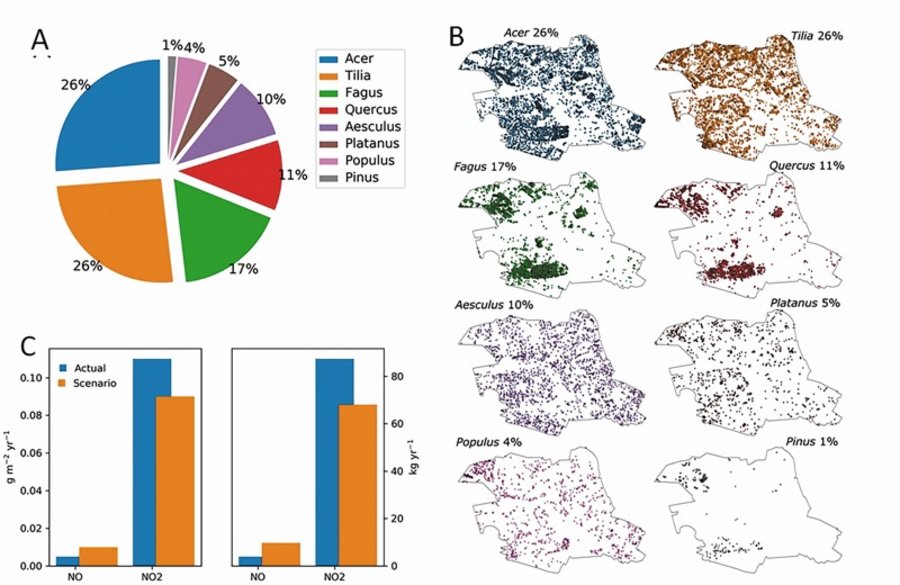
Insgesamt zeigten die NOx-spezifischen Depositionsgeschwindigkeiten keine signifikanten Unterschiede (Abbildung 1D). Basierend auf den ermittelten NOx-Depositionsraten wurde ein Baumbestand für die Reduktion von NOx in Berlin-Mitte definiert. Die vier dominanten Baumgattungen in diesem Gebiet, die in Abbildung 3A dargestellt sind und die Standardsimulation repräsentieren, wurden durch C. betulus, F. ornus, F. pennsylvanica und O. carpinifolia ersetzt. Hierbei wurde auch die Verteilung der einzelnen Baumarten innerhalb des Bezirks Berlin-Mitte berücksichtigt (Abbildung 3B).
Die Simulationen zeigen, dass die gesamte Schadstoffentfernung der neu untersuchten Arten in der gleichen Größenordnung liegt wie die der vier derzeit dominierenden Gattungen. Nach unseren groben Schätzungen, die keine Veränderungen der Baumdimensionen oder Baumpositionen und einen gleichen Anteil der Abundanz der neuen Arten annehmen, würde sich die gesamte jährliche NO-Deposition mehr als verdoppeln, während die NO2-Deposition leicht um ~20 Prozent abnehmen würde (Abbildung 3C).
Verbesserte NO-Aufnahme in Phytoglobin-transgenen Arabidopsis und Pappel
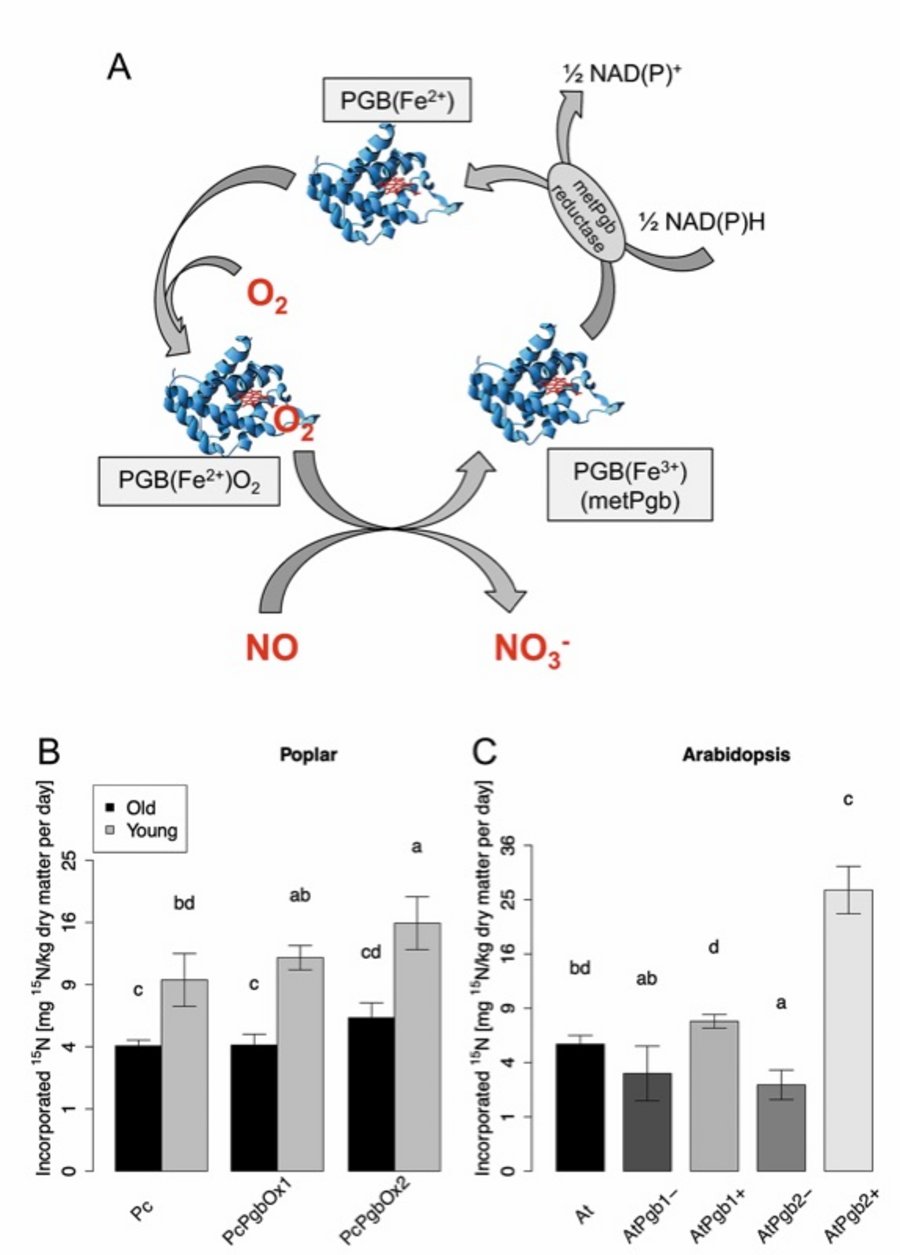
Wie bereits für Arabidopsis und Gerste berichtet, sind PGBs in der Lage, atmosphärisches NO in Stickstoffmetaboliten zu fixieren (Kuruthukulangarakoola et al., 2017; Zhang et al., 2019). Der Reaktionsmechanismus der NO-Fixierung durch PGB ist in Abbildung 4A dargestellt.
Um zu untersuchen, ob eine verstärkte Produktion von PGBs die NO-Aufnahme in Bäumen erhöhen kann, wurden transgene Graupappeln generiert, die das Arabidopsis AtPGB1 beziehungsweise AtPGB2 produzieren. Die enzymatisch abhängige NO-Aufnahmekapazität dieser transgenen Linien wurde an vier 40 Tage alten Bäumen und drei 15 Tage alten Pappeln untersucht. Die Bäume wurden an fünf aufeinanderfolgenden Tagen unter kontrollierten Umweltbedingungen 50 ppb by volume markiertem ¹5NO ausgesetzt. Anschließend wurde die ¹5N-Markierung im geernteten Blattmaterial untersucht. Wildtyp-Pappeln des entsprechenden Alters sowie transgene Arabidopsis-Pflanzen mit verstärkter und reduzierter Produktion der PGB wurden als Kontrollen verwendet (Abbildungen 4B-C). Die ¹5N-Konzentrationen in AtPGB-überexprimierenden Pflanzen waren höher als in den entsprechenden WT- und PGB-Knockdown/Knockout-Mutanten (Abbildung 4B), wodurch bestätigt wurde, dass eine erhöhte Produktion von PGBs zu einer höheren NO-Aufnahmekapazität des Blattwerks in Bäumen führt. Interessanterweise wurde eine höhere ¹5N-Inkorporation in jungen Pappeln (15 Tage alte Pappeln) im Vergleich zu älteren (40 Tage alte Pappeln) Pflanzen beobachtet (Abbildung 4B).
Zusammenfassend kann gesagt werden, dass es durchaus zu empfehlen ist, für zukünftige Begrünungsmaßnahmen in Städten Baum-/Pflanzenarten zu wählen, die eine relativ hohe NO- und NO2-Aufnahme-/Deponierungskapazität besitzen, da sie ein praktikables Mittel zur Reduzierung des atmosphärischen NOx-Gehalts darstellen und somit zur Einhaltung von Luftreinhaltungsstandards beitragen können. Die Auswahl geeigneter Baum-/Pflanzenarten, die in der Lage sind, mit erhöhtem Hitze- und Trockenstress umzugehen und gleichzeitig eine hohe Kapazität zur "Reinigung" der Luft beizubehalten, kann somit Stadtplanungsstrategien unterstützen. Auch die NO-Fixierungsfähigkeit von PGBs könnte ein wertvolles Merkmal sein, das zunehmend zur Charakterisierung von Baum-/Pflanzenarten im Zusammenhang mit der städtischen Luftqualität eingesetzt werden könnte.
Zusammenfassung
Stickoxide (NOx), hauptsächlich ein Gemisch aus Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2), entstehen durch die Reaktion von Stickstoff- und Sauerstoffverbindungen infolge von Verbrennungsprozessen (Holzöfen, Kraftfahrzeuge, Blitze). Die Stickoxide lagern sich auf der Blattoberfläche ab oder gelangen über die Spaltöffnungen in die Blätter, was zum einen der Luftqualität zugutekommt und zum anderen eine zusätzliche Stickstoffquelle für die Pflanzen darstellt. Zunächst haben wir die NO- und NO2-spezifischen Depositionsgeschwindigkeiten auf Basis der projizierten Blattfläche (sVd) bestimmt.
Wir untersuchten vier Baumarten, die als geeignet angesehen werden, um unter den vorhergesagten zukünftigen städtischen Klimabedingungen gepflanzt zu werden: Carpinus betulus, Fraxinus ornus, Fraxinus pennsylvanica und Ostrya carpinifolia (Stadtgrün 2021). Die NO- und NO2 sVd wurden in allen Baumarten als ähnlich befunden. Um die NO-Metabolisierung zu untersuchen, begasten wir die Pflanzen mit ¹5NO und quantifizierten den Einbau von ¹5N in das Blattmaterial dieser Bäume und vier weiterer Stadtbaumarten (Celtis australis, Alnus spaethii, Alnus glutinosa und Tilia henryana) unter kontrollierten Umweltbedingungen. Basierend auf diesen ¹5N-Markierungsexperimenten zeigte A. glutinosa den effektivsten Einbau von ¹5NO.
Außerdem versuchten wir, den Mechanismus der Metabolisierung aufzuklären. Dazu haben wir transgene Pappeln erzeugt, die Arabidopsis thaliana Phytoglobin 1 oder 2 überexprimieren. Von Phytoglobinen ist bekannt, dass sie NO in Gegenwart von Sauerstoff zu Nitrat metabolisieren. Der ¹5N-Gehalt in Phytoglobin-überexprimierenden Pappeln war im Vergleich zu Wildtyp-Bäumen signifikant erhöht, was zeigt, dass die NO-Aufnahme neben der stomatären Abhängigkeit auch enzymatisch kontrolliert wird.
Die ermittelten Daten wurden anschließende verwendet, um eine Modellierung der NO- und NO2-Deposition für das Gebiet von Berlin-Mitte durchzuführen. Würden die derzeit dominierenden Laubbaumarten (Acer platanoides, Tilia cordata, Fagus sylvatica, Quercus robur) durch die für zukünftige Bedingungen vorgeschlagenen Arten ersetzt, würde sich die gesamte jährliche NO- und NO2-Deposition im modellierten Stadtgebiet kaum verändern. D. h. die Leistung der Luftschadstoffbeseitigung würde nicht verschlechtert werden. Diese Ergebnisse können bei der Auswahl von Stadtbaumarten in zukünftigen Begrünungsprogrammen helfen.
Referenzen
Becana et al. (2020). Plant hemoglobins: a journey from unicellular green algae to vascular plants. New Phytologist; doi:10.1111/nph.16444.
Böll, S. (2017). 7 Jahre "Stadtgrün 2021" - Einfluss des regionalen Klimas auf das Baumwachstum an drei bayerischen Standorten. Jahrbuch der Baumpflege, S. 91-114.
Böll, S. (2018a). Stadtbäume der Zukunft - Wichtige Erkenntnisse aus dem Forschungsprojekt "Stadtgrün 2021". www.lwg.bayern.de/landespflege/urbanes_gruen/085113/index.php.
Böll, S. (2018b) "Projekt Stadtgrün 2021" Selektion, Anzucht und Verwendung von Gehölzen unter sich ändernden klimatischen Bedingungen. Abschlussbericht zum Forschungsvorhaben Nr.: KL/17/03.
Breuninger et al. (2013). Field investigations of nitrogen dioxide (NO2) exchange between plants and the atmosphere. Atmospheric Chemistry and Physics 13, 773-790.
Burley et al. (2019). Substantial declines in urban tree habitat predicted under climate change. Science of the Total Environment 685, 451-462.
Chaparro-Suarez et al. (2011). Nitrogen dioxide (NO2) uptake by vegetation controlled by atmospheric concentrations and plant stomatal aperture. Atmospheric Environment 45, 5742-5750.
Delaria et al. (2018). Measurements of NO and NO2 exchange between the atmosphere and Quercus agrifolia. Atmospheric Chemistry and Physics 18, 14161-14173.
Dickhaut, W., and Eschenbach, A. (2019). Entwicklungskonzept Stadtbäume - Anpassungsstrategien an sich verändernde urbane und klimatische Rahmenbedingungen. HafenCity Universität Hamburg.
EEA, 2019. Air quality in Europe 2019, European Environmental Agency, EEA report No 10/2018.
Elkiey et al. (1982). Foliar sorption of sulfur dioxide, nitrogen dioxide and ozone by ornamental woody plants. HortScience 17, 358-359.
Eller, A. S. D., and Sparks, J. P. (2006). Predicting leaf-level fluxes of O3 and NO2: The relative roles of diffusion and biochemical processes. Plant, Cell and Environment 29, 1742-1750.
Geßler et al. (2002). Stomatal uptake and cuticular adsorption contribute to dry deposition of NH3 and NO2 to needles of adult spruce (Picea abies) trees. New Phytologist 156, 179-194.
Hanson, P. J., and Lindberg, S. E., (1991). Dry deposition of reactive nitrogen compounds: A review of leaf, canopy and non-foliar measurements. Atmos. Environ. 25, 1615-1634.
Hill, A. C. (1971). Vegetation: A sink for atmospheric pollutants. Journal of the Air Pollution Control Association 21, 341-346.
Igamberdiev et al. (2006). Nitric oxide scavenging by barley hemoglobin is facilitated by a monodehydroascorbate reductase-mediated ascorbate reduction of methemoglobin. Planta 223, 1033-1040.
Igamberdiev, A. U., and Hill, R. D. (2004). Nitrate, NO and haemoglobin in plant adaptation to hypoxia: An alternative to classic fermentation pathways. Journal of Experimental Botany 55, 2473-2482.
Jud et al. (2016). Plant surface reactions: an ozone defence mechanism impacting atmospheric chemistry. Atmospheric Chemistry and Physics 16, 277-292.
Kabisch, N., and van den Bosch M.A. (2017). Urban green spaces and the potential for health improvement and environmental justice in a changing climate. In: Kabisch N., Korn H., Stadler J., Bonn A. (eds) Nature-Based Solutions to Climate Change Adaptation in Urban Areas. Theory and Practice of Urban Sustainability Transitions. Springer, Cham.
Kuruthukulangarakoola et al. (2017). Nitric oxide-fixation by non-symbiotic haemoglobin proteins in Arabidopsis thaliana under N-limited conditions. Plant Cell and Environment 40, 36-50.
Mannucci et al. (2015). Effects on health of air pollution: a narrative review. Internal and Emergency Medicine 10, 657-662.
Morikawa et al. (1998). More than a 600-fold variation in nitrogen dioxide assimilation among 217 plant taxa. Plant, Cell and Environment 21, 180-190.
Rogers et al. (1979). Nitrogen-15 dioxide uptake and incorporation by Phaseolus vulgaris (L.). Science 206, 333-335.
Roloff, A., Korn, S., and Gillner, S. (2009). The Climate-Species-Matrix to select tree species for urban habitats considering climate change. Urban Forestry and Urban Greening 8, 295-308.
Salmond et al. (2016). Health and climate related ecosystem services provided by street trees in the urban environment. Environmental Health 15, S36.
Soegiarto et al. (2003). Nitric oxide degradation in oxygen atmospheres and rate of uptake by horticultural produce. Postharvest Biology and Technology 28, 327-331.
Sparks et al. (2001). Leaf uptake of nitrogen dioxide (NO2) in a tropical wet forest: Implications for tropospheric chemistry. Oecologia 127, 214-221.
Takahashi et al. (2005). Differential assimilation of nitrogen dioxide by 70 taxa of roadside trees at an urban pollution level. Chemosphere 61, 633-639.
Zhang et al. (2019). Phytoglobin overexpression promotes barley growth in the presence of enhanced level of atmospheric nitric oxide. Journal of Experimental Botany 70, 4521-4537.
Zhao et al. (2016). Common ragweed (Ambrosia artemisiifolia L.): allergenicity and molecular characterization of pollen after plant exposure to elevated NO2. Plant Cell and Environment 39, 147-164.
1 Institut für Biochemische Pflanzenpathologie, Helmholtz Zentrum München, Ingolstädter Landstraße 1, D-85764 Neuherberg/München, Deutschland
2 Forschungsbereich Umweltsimulation, Institut für Biochemische Pflanzenpathologie, Helmholtz Zentrum München, Ingolstädter Landstraße 1, D-85764 Neuherberg/München, Deutschland
3 Department of Agriculture, Food, Environment, and Forestry (DAGRI), Universität Florenz, I-50019 Sesto Fiorentino (Florenz), Italien
4 Abteilung für Biologie, Landwirtschaft und Lebensmittelwissenschaften, Nationaler Forschungsrat Italiens (CNR), Institut für nachhaltigen Pflanzenschutz, I-50019 Sesto Fiorentino (Florenz), Italien
5 Karlsruher Institut für Technologie, Institut für Meteorologie und Klimaforschung - Institut für Atmosphärische Umweltforschung, D-82467 Garmisch-Partenkirchen, Deutschland
6 Institut für Forschung über terrestrische Ökosysteme (IRET), Nationaler Forschungsrat (CNR), I-05010 Porano (TR), Italien
7 Lehrstuhl für Biochemische Pflanzenpathologie, Technische Universität München, 85354 Freising, Deutschland
8 College of Life Sciences, Henan Normal University, 453007 Xinxiang, China.